Фуллерены против амилоидов: под контролем нейтронов
Публикации, 14 мая 2021
Мы уже рассказывали, об использовании учеными ЛНФ методов нейтронного рассеяния для изучения структурных свойств биомиметических мембран, играющих важную роль в процессе развития конформационных заболеваний, таких как болезнь Альцгеймера. Сегодня мы публикуем материал о другом направлении исследований в Лаборатории нейтронной физики ОИЯИ, связанных с поиском путей борьбы с этими заболеваниями, — изучении способности фуллеренов разрушать амилоидные образования и механизмов такого воздействия.
Сотрудники ОИЯИ используют все возможные методы, включая нейтронное рассеяние, чтобы изучить активность фуллеренов при разрушении амилоидных образований и выявить механизмы этих превращений. Исследования ученых открывают новый путь к созданию антиамилоидных нанолекарств для лечения таких нейродегенеративных заболеваний, как болезнь Альцгеймера.
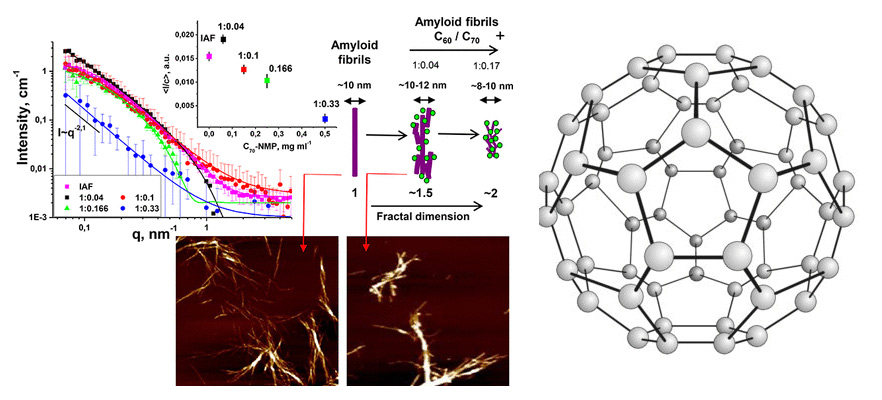 Стадии разрушения амилоидных фибрилл (Reprinted with permission from ACS Applied Materials & Interfaces. Copyright 2020 American Chemical Society) и Фуллерен C60 (Википедия).
Стадии разрушения амилоидных фибрилл (Reprinted with permission from ACS Applied Materials & Interfaces. Copyright 2020 American Chemical Society) и Фуллерен C60 (Википедия).
Фуллерены: наночастицы-нейропротекторы
Амилоидозы – главная причина смерти после сердечно-сосудистых и раковых заболеваний. По невыясненным пока причинам в организме нарушается нормальное сворачивание белков и пептидов, и в разных органах и тканях организма накапливаются амилоидные фибриллы. Образующиеся агрегаты оказывают токсическое действие на окружающие клетки и вызывают ряд заболеваний. Сегодня насчитывают более пятидесяти таких заболеваний, среди них болезнь Альцгеймера, Паркинсона, диабет, системные амилоидозы и многие другие. При каждом заболевании нарушается свертывание различных белков (сегодня известно более 30) – τ-белка, Аβ-пептидов, инсулина, лизоцима или других, но образуемые при этом фибриллы имеют общую структуру и свойства. Наиболее распространенную и тяжелую болезнь Альцгеймера, например, вызывает накопление в головном мозге большого количества Аβ-пептидов. Из слипающихся пептидов вырастают бляшки, уничтожающие клетки мозга и приводящие к постепенному угасанию умственной деятельности.
К сожалению, механизм амилоидогенеза до конца не выяснен. Как предупредить образование фибрилл, заранее их обнаружить и назначить эффективное лечение? При выборе перспективной стратегии для лечения амилоидозов исследователи в последние годы все чаще обращают внимание на нейропротекторные свойства наночастиц и их антиамилоидную активность.
С момента открытия фуллеренов, углеродных наночастиц, прошло более 30 лет. За это время первооткрывателей успели наградить Нобелевской премией по химии (1996, Robert F. Curl, Jr., Harold W. Kroto, Richard E. Smalley), исследователи научились получать в достаточном количестве эти наночастицы, образовалось и бурно развивается новое направление «химия фуллеренов». Уникальные свойства, например, букминстерфуллерена или фуллерена C60, самого стабильного представителя семейства фуллеренов, сегодня находят широкое применение в разных областях физики, электрохимии и медицины. Интенсивное исследование противоопухолевой, антиоксидантной и антибактериальной активности фуллеренов открывает новые возможности для их биомедицинских приложений в качестве контрастных веществ для визуализации, биосенсоров, новых лекарственных форм и средств направленной доставки радиофармпрепаратов и лекарственных веществ. В зависимости от размера, заряда, формы и состава наночастицы могут по-разному влиять на фибрилляцию амилоидов белка, а также использоваться для обнаружения амилоидных скоплений. Нейропротекторные свойства фуллеренов и антиамилоидная активность во многом обусловлены их антиоксидантными свойствами, небольшим размером (около 0.7 нанометров в диаметре), уникальной структурой и способностью преодолевать биологические барьеры, проникая через мембраны различных типов клеток.
Несмотря на активные исследования большого потенциала фуллеренов для лечения амилоидоза, полное описание механизма разрушения амилоида еще не получено. Недостаточно и экспериментальных доказательств способности фуллеренов разрушать амилоидные скопления и влиять на различные белковые агрегаты (отличные от Аβ-пептидов). Это ключевые моменты для успешного будущего использования фуллеренов в терапии нейродегенеративных и связанных с образованием амилоидов заболеваний.
Ответы на эти вопросы вместе с коллегами из других российских и европейских исследовательских центров* искали ученые ОИЯИ, которые не первый год занимаются исследованием биологической и антиамилоидной активности фуллеренов.
Скоплением научных методов по скоплению амилоидов (флуоресцентный анализ, атомно-силовая микроскопия, малоугловое рассеяние нейтронов)
«Наша работа преследовала две цели: мы хотели оценить антиамилоидную активность водных раствора фуллеренов C60 и C70 на основе N-метилпирролидона (NMP) и проанализировать механизм разборки амилоида. Это важные моменты для дальнейшего успешного использования фуллеренов и других наночастиц в лечении заболеваний, связанных с образованием амилоидных фибрилл», — объяснил участник исследований Михаил Авдеев, сотрудник Лаборатории нейтронной физики ОИЯИ. Для этого ученые использовали комбинацию различных биофизических и биохимических методов, а также малоугловое рассеяние нейтронов, применяя наработки предыдущих совместных исследований с группами Петера Копчанского из Института экспериментальной физики Словацкой академии наук (ИЭФ САН) и Леонида Булавина из Киевского национального университета им. Тараса Шевченко.
Для исследований они выбрали два белка: человеческий инсулин и лизоцим (из яичного белка курицы). Амилоидные фибриллы белков подвергали воздействию водных растворов фуллеренов повышенной концентрации C60 и C70 (на основе NMP). NMP не только растворяет и стабилизирует молекулы фуллерена, контролируя размер их агрегатов, но смешивается с водой и используется как сорастворитель в медицинских препаратах.
Скорость распада фибрилл позволяет проследить флуоресцентный анализ (с красителем тиофлавином), так как интенсивность флуоресценции коррелирует со степенью агрегации амилоида. «Во время наблюдений мы сделали два важных вывода, — рассказал Михаил Авдеев, — во-первых, выбранные фуллерены способны разбирать предварительно образованные амилоидные фибриллы белка при низких (микрограммы) концентрациях и низком соотношении белка к фуллерену. Во-вторых, значения концентраций фуллеренов, при которых происходит распад амилоидов, для обоих белков близки».
Постепенное изменение структуры и строения фибрилл, взаимодействующих с фуллеренами, исследователи сначала зафиксировали с помощью атомно-силовой микроскопии (АСМ). Амилоидные скопления инсулина и лизоцима выглядят как пучки неразветвленных фибрилл со средней высотой в 10 нанометров и длиной до нескольких микрометров. Добавка фуллеренов в нарастающей концентрации привела к постепенному исчезновению большинства амилоидных фибрилл обоих белков. Если данные эксперимента АСМ собирали на высушенных образцах, то метод малоуглового рассеяния нейтронов дает возможность следить за морфологией фибрилл непосредственно в концентрированных растворах. Эксперименты, проведенные на установке малоуглового рассеяния нейтронов ЮМО импульсного реактора (ИБР-2, ОИЯИ, Дубна), позволяют сделать предположения о механизме распада амилоидных скоплений под воздействием фуллеренов. Сначала фуллерены адсорбируются на поверхности белка с образованием крупных разветвленных агломератов из фуллеренов и фибрилл. Затем от этих сгустков постепенно отделяются структурные единицы до полного исчезновения белковых агрегатов. Несмотря на использование двух разных белков и разных фуллеренов, механизм разборки фибрилл оказался общим. При низкой концентрации раствора фуллеренов активного разрушения фибрилл не наблюдается: образуются более разветвленные пучки агломератов из фибрилл, размеры которых превышают величину необработанных скоплений белка. По мере увеличения концентрации фуллеренов белковые глобулы увеличиваются в размерах и начинают разрушаться за счет отрыва структурных единиц.
МУРН: в фокусе биомедицина
Ученые отмечают уникальность метода малоуглового рассеяния нейтронов (МУРН) при изучении сложных многокомпонентных растворов, с которыми приходится сталкиваться в реальной жизни при решении биомедицинских проблем. Они использовали эмпирическую модель (Гинье-Порода) для подробного анализа МУРН-данных о структуре фибрилл до и после добавления фуллеренов. Эта модель позволяет не только определять размеры и форму частиц при рассеянии, в том числе, асимметричных стержней или пластинок, но, что более важно, она работает для частиц промежуточной формы (между сферой и асимметричными объектами).
Подобрав специальным образом условия эксперимента, а именно, концентрацию фуллеренов в растворе, контраст между растворителем («тяжелая вода», D2O) и фуллеренами, ученые добились, чтобы сигнал от рассеяния нейтронов на фуллеренах оставался на фоновом уровне. В этом случае регистрируемый сигнал (за вычетом фона) связан только с амилоидными фибриллами, что позволяет точно определять изменения в структуре фибрилл под действием раствора фуллеренов.
Авторы исследования считают, что выбранные растворы фуллеренов C60 и C70 на основе N-метилпирролидона, которые обладают как гидрофобными, так и гидрофильными свойствами, содержат уникальные и перспективные наночастицы для разрушения амилоидов.
«Наша работа показывает, насколько важную роль играют методы малоуглового рассеяния при исследовании разрастания амилоидных скоплений и разрушения фибрилл. Данные экспериментов представляют ценные сведения о молекулярном механизме, с помощью которого фуллерены разрушают нежелательные амилоидные скопления. И поэтому могут быть использованы при создании наноразмерных материалов со значительным антиамилоидным эффектом», — подытожил профессор Андрей Мусатов, представитель биофизического отдела ИЭФ САН.
Способность фуллеренов разрушать другие виды амилоидных образований требует дальнейшего изучения.
* Katarina Siposova, Viktor I. Petrenko, Oleksandr I. Ivankov, Andrey Musatov, Leonid A. Bulavin, Mikhail V. Avdeev, and Olena A. Kyzyma. ACS Applied Materials & Interfaces 2020 12 (29), 32410-32419 DOI: 10.1021/acsami.0c07964
Ольга Баклицкая-Каменева