Коллаборация лабораторий ОИЯИ в поиске первопричин болезни Альцгеймера
Новости, 15 февраля 2021
Нейтроны и молекулярное моделирование: по следам разрушения нейронных мембран пептидом бета-амилоидом
По статистике у каждого десятого человека преклонного возраста выявляется существенное снижение когнитивных функций мозга. И очень часто причиной этого становится болезнь Альцгеймера — нейродегенеративное заболевание, характеризующееся гибелью нервных клеток головного мозга. Болезнь на данный момент плохо изучена и принадлежит к категории неизлечимых. С 2019 года коллаборация ЛНФ, ЛИТ и ЛРБ при поддержке гранта РНФ (№ 19-72-20186) ведет работу по изучению свойств клеточных мембран и клеточных взаимодействий, чтобы понять и изучить механизмы возникновения болезни Альцгеймера.
Итак, болезнь Альцгеймера – нейродегенеративное заболевание головного мозга, впервые описанное немецким психиатром Алоисом Альцгеймером в 1907 году и являющееся самой распространенной формой деменции (60% — 70% всех случаев), характеризующейся нарушением когнитивных и физических способностей человека. Во всем мире насчитывается около 50 миллионов человек, страдающих деменцией и, по прогнозам, это число составит около 75 миллионов к 2030 году и 131 миллиона – к 2050 [1].
В настоящее время не существует точного и ясного понимания причин возникновения болезни Альцгеймера. Однако, существует несколько гипотез, пытающихся объяснить происхождение данного заболевания. Наиболее актуальными из них являются наследственная гипотеза [2], холинергическая гипотеза [3], амилоидная гипотеза [4] и тау-гипотеза [5].
Амилоидную гипотезу, возникшую в 1991 году, связывают с пептидом бета-амилоидом, образующимся вследствие протеолитического расщепления гликопротеина ПБА (предшественник бета-амилоида), в норме всегда присутствующего в мембранах нейронов и других клеток. В определенных условиях олигомер бета-амилоида может претерпеть неправильную конформационную перестройку, приводящую к переходу “нормальных” растворимых пептидов в токсичную конформацию, вызывая образование нитевидных агрегатов – нерастворимых жестких фибрилл больших размеров, являющихся признаком болезни. Однако токсическим действием, оказывающим разрушительное влияние на нервные клетки мозга, обладают одиночные неправильно свернутые пептиды, рожденные в мембране клеток (рис. 1) [6].
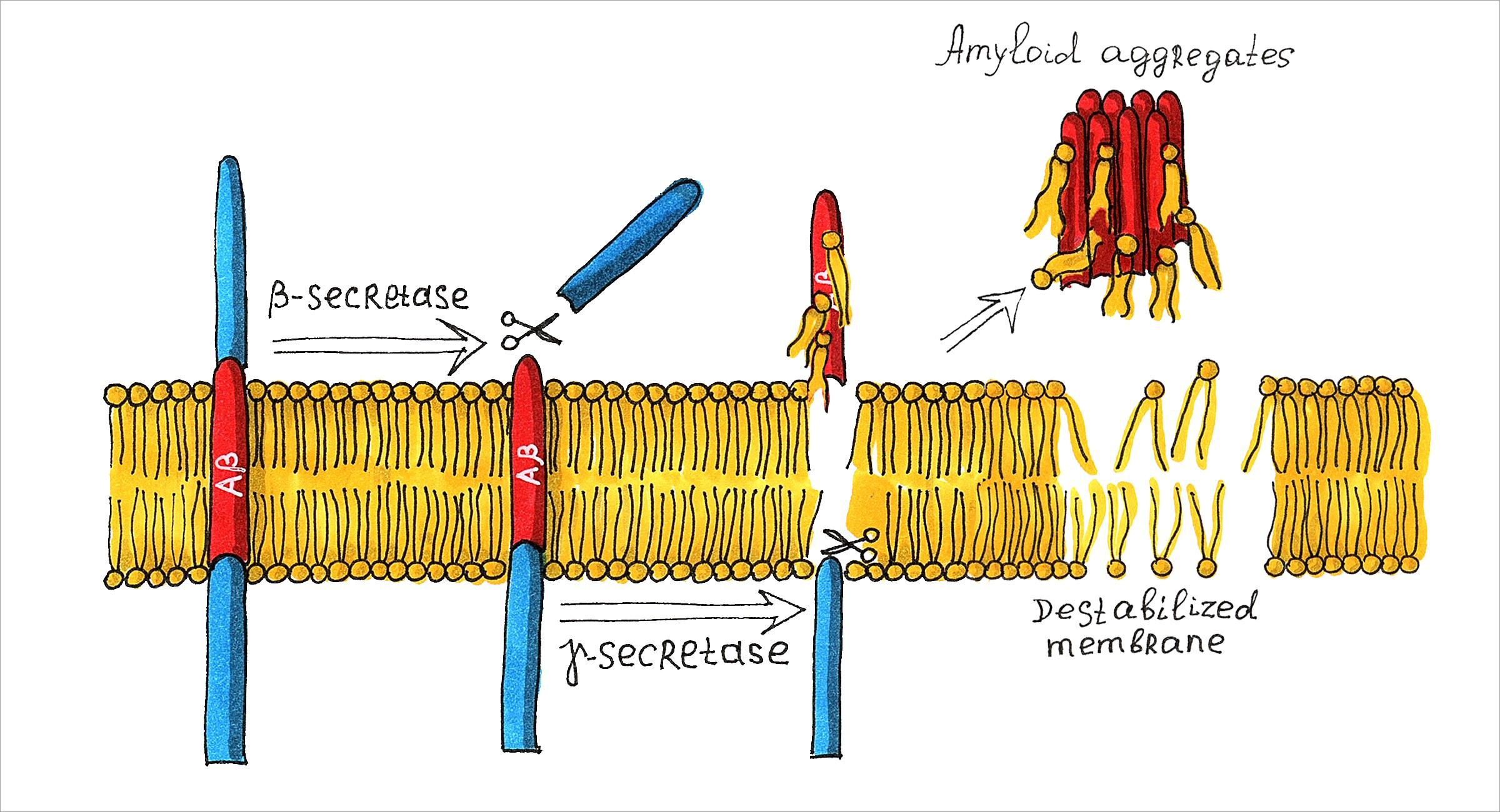 Рис. 1. Эскиз амилоидной гипотезы возникновения болезни Альцгеймера. В результате расщепления трансмембранного белка предшественника бета-амилоида β-секретазой и γ-секретазой по амилоидогенному пути формируются нерастворимые и склонные к агрегации фрагменты Aβ, в случае неправильной свертки обладающие токсическим действием.
Рис. 1. Эскиз амилоидной гипотезы возникновения болезни Альцгеймера. В результате расщепления трансмембранного белка предшественника бета-амилоида β-секретазой и γ-секретазой по амилоидогенному пути формируются нерастворимые и склонные к агрегации фрагменты Aβ, в случае неправильной свертки обладающие токсическим действием.
Считается, что важную роль на начальном этапе болезни Альцгеймера играют взаимодействия пептида бета-амилоида и клеточной мембраны, регулируемые ее составом, коррелирующим со структурно-динамическими и упруго-механическими свойствами мембраны [7]. Очевидно, что исследование влияния состава и свойств мембраны является необходимым условием для полного понимания механизмов образования болезни Альцгеймера. С 2019 года коллаборация ЛНФ, ЛИТ и ЛРБ при поддержке гранта РНФ (№ 19-72-20186) ведет работу в указанном направлении. Используя такие экспериментальные и теоретические методы исследования, как малоугловое рассеяние нейтронов и рентгеновских лучей и неупругое рассеяние нейтронов, проводимые на установках ЮМО и НЕРА реактора ИБР-2, Rigaku (МФТИ), калориметрию, денситометрию и моделирование методом молекулярной динамики на гетерогенной платформе HybriLIT, мы проливаем свет на влияние структурных (толщина бислоя, площадь поверхности в латеральной плоскости на границе раздела вода-липид, уровень гидратации) и динамических (эластичность, диффузия) свойств мембраны, и/или химических свойств липидов (состав и заряд головы, длина и ненасыщенность углеводородных хвостов) на пептидно-мембранные взаимодействия.
В настоящее время в работе методами малоуглового рассеяния нейтронов и молекулярной динамики исследованы модельные системы различных биологических мембран в присутствии ионов и с добавлением холестерина, мелатонина и пептида бета-амилоида [8-10]. Известно, что катионы металлов взаимодействуют с мембраной клетки, связываясь с полярной головой образующих бислой липидов. При этом изменяется толщина и структура мембраны, что влияет на конформации и функции различных белков, встроенных в нее.
Влияние холестерина вызывает заметное увеличение толщины мембраны, связанное с тем, что холестерин упорядочивает углеводородные хвосты липидов и, следовательно, вызывает их удлинение, что увеличивает толщину и повышает вязкость мембраны. Эффект влияния мелатонина, уменьшающего толщину мембраны, связан с разупорядочением липидных хвостов, так как молекулы мелатонина локализуются в области фосфолипидных голов и приводят к увеличению расстояния между ними. Это увеличивает конформационное пространство для липидных хвостов и, следовательно, уменьшает параметр порядка в бислое, что вызывает уменьшение толщины и снижение вязкости мембраны.
Кроме того, рассматривая взаимодействие пептида бета-амилоида с модельными липидными мембранами, содержащими холестерин и мелатонин, при помощи методов малоуглового рассеяния нейтронов и нейтронной дифракции, выдвинуто предположение о преимущественной локализации пептида в головных группах липидов мембраны. В случае встраивания пептида в модельную мембрану он в основном располагается в областях под головной группой липидов, а также на границе раздела вода-липид, увеличивая толщину мембраны. При добавлении холестерина в мембрану локализация пептида практически не изменяется. Данный эффект можно объяснить тем, что холестерин локализован в области хвостовых групп и не взаимодействует с пептидом. Добавление в мембрану мелатонина, обладающего разжижающим эффектом, оказывает влияние на локализацию пептида, предположительно смещая его в сторону водно-липидной границы. Визуализация результатов моделирования методом молекулярной динамики также показала стремление молекул пептида к локализации в головных группах липидов, как и увеличение толщины мембраны (рис. 2). Также было продемонстрировано значительное конформационное изменение молекул пептидов – переход из альфа-спиралей в неупорядоченные вторичные структуры.
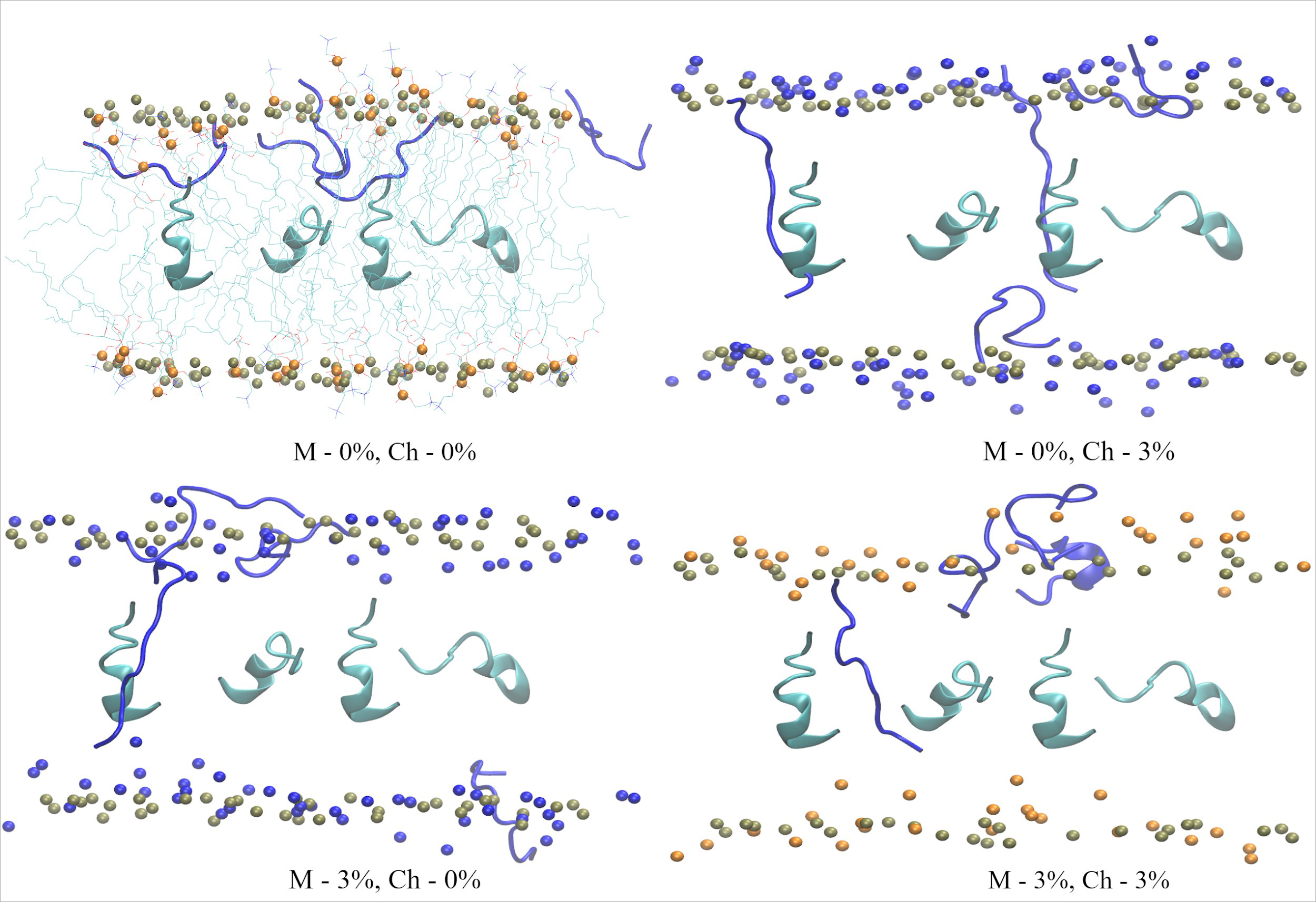 Рис. 2. Снимки молекулярно-динамического моделирования, демонстрирующие локализацию пептида бета-амилоида при взаимодействии с липидными бислоями, содержащими холестерин (Ch) и мелатонин (M) в различных концентрациях. Бирюзовым цветом обозначены пептиды в начальный момент времени моделирования, синим — в конечный момент.
Рис. 2. Снимки молекулярно-динамического моделирования, демонстрирующие локализацию пептида бета-амилоида при взаимодействии с липидными бислоями, содержащими холестерин (Ch) и мелатонин (M) в различных концентрациях. Бирюзовым цветом обозначены пептиды в начальный момент времени моделирования, синим — в конечный момент.
С помощью методов дифференциальной сканирующей калориметрии и денситометрии получено, что добавление холестерина и встраивание пептида в мембрану увеличивают температуру фазового перехода, что усиливает плотность упаковки липидов и делает мембрану более жесткой. Добавление мелатонина в мембрану уменьшает температуру главного фазового перехода и плотность упаковки липидов и делает мембрану более текучей.
Дополнительно изучено влияние термодинамического состояния мембраны на встраивание в нее пептида бета-амилоида. По характеру изменения толщины мембраны можно сделать вывод, что в упорядоченной гель-фазе встраивание пептида оказывает большее влияние на систему в целом и толщину мембраны в частности. В случае разупорядоченной жидкокристаллической фазы встраивание пептида также влияет на толщину мембраны, однако этот эффект значительно ниже. При этом впервые обнаружен эффект влияния температуры на перестроение формы мембраны (изменение размера сферической везикулы и формирование нанодисков), который непосредственно связан с присутствием пептида в мембране. Этот процесс полностью обратим, и в отсутствие пептида размеры везикул остаются без изменений, что однозначно свидетельствует о разрушающем действии пептида (рис. 3).
 Рис. 3. Кривые малоуглового рассеяния нейтронов, демонстрирующие деструктивное влияние пептида бета-амилоида на модельную мембранную систему. Под влиянием температуры и в присутствии пептида, форма модельной системы изменяется от больших везикул до везикул малого размера и нанодисков.
Рис. 3. Кривые малоуглового рассеяния нейтронов, демонстрирующие деструктивное влияние пептида бета-амилоида на модельную мембранную систему. Под влиянием температуры и в присутствии пептида, форма модельной системы изменяется от больших везикул до везикул малого размера и нанодисков.
Получаемая в ходе данного исследования информация о взаимосвязи структуры и функций мембран представляет несомненный интерес в прикладных и фармацевтических областях, связанных с исследованиями межклеточной коммуникации, транспорта белков, а также регулирования захвата и транспорта холестерина. Например, полученные результаты демонстрируют ключевую роль вязкости мембраны при встраивании в нее пептида, а именно значительное уменьшение влияния пептида в мембране с мелатонином по сравнению с модельной мембраной и мембраной с холестерином, и могут быть использованы в дальнейших исследованиях патогенности этого амилоида, поскольку они могут дать некоторое представление о молекулярном механизме защитной функции мелатонина при болезни Альцгеймера.
С развитием современных экспериментальных методик, усовершенствованием источников нейтронного и рентгеновского излучения, разработкой дополнительных эффективных инструментов детектирования и увеличением мощностей вычислительных кластеров начался новый виток в изучении болезни Альцгеймера, занимающей важнейшее место в биомедицинских исследованиях. Безусловно, исследование данного заболевания далеко от завершения, однако уже получен ряд важных результатов, таких как гипотезы, описывающие происхождение болезни, модели, описывающие взаимодействия, приводящие к возникновению заболевания, но самое главное появляются предложения по возможным методам борьбы с болезнью. Возможно, использование рассеяния нейтронов в более пристальном рассмотрении взаимодействия клеточной мембраны и пептида бета-амилоида и станет частью окончательного решения в победе над болезнью Альцгеймера.
Д. Р. Бадреева, П. Грубовчак, Э. Б. Душанов, Е. В. Ермакова, А. И. Иваньков,
Т. Кондела, А. И. Куклин, С. А. Куракин, Т. Н. Муругова, В. В. Ской,
Д. В. Соловьев, Х. Т. Холмуродов и Н. Кучерка
Список литературы
- Prince M., Wimo A., Guerchet M., Ali G. C., Wu Y. T., Prina M. (2015). The global impact of dementia: an analysis of prevalence, incidence, cost and trends. World Alzheimer Report, 2015.
- Reitz C., Mayeux R. (2014). Alzheimer disease: epidemiology, diagnostic criteria, risk factors and biomarkers. Biochemical pharmacology, 88(4), 640-651.
- Francis P. T., Palmer A. M., Snape M., Wilcock G. K. (1999). The cholinergic hypothesis of Alzheimer’s disease: a review of progress. Journal of Neurology, Neurosurgery & Psychiatry, 66(2), 137-147.
- Hardy J., Allsop D. (1991). Amyloid deposition as the central event in the aetiology of Alzheimer’s disease. Trends in pharmacological sciences, 12, 383-388.
- Mudher A., Lovestone S. (2002). Alzheimer’s disease – do tauists and baptists finally shake hands?. Trends in neurosciences, 25(1), 22-26.
- Hardy J., Selkoe D. J. (2002). The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics. science, 297(5580), 353-356.
- Niu Z., Zhang Z., Zhao W., Yang, J. (2018). Interactions between amyloid β peptide and lipid membranes. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1860(9), 1663-1669.
- Kurakin S. A., Ermakova E. V., Ivankov O. I., Smerdova S. G., Kučerka N. (2021). The effect of divalent ions on the bilayer structure of dimyristoylphosphatidylcholine vesicles. Journal of Surface Investigation: X-ray, Synchrotron and Neutron Techniques, 3.
- Murugova T., Ivankov O., Ermakova E., Kondela T., Hrubovčák P., Skoi V., Kuklin A., Kučerka N. (2020). Structural changes introduced by cholesterol and melatonin to the model membranes mimicking preclinical conformational diseases. General physiology and biophysics, 39(2), 135-144.
- Ivankov O. I., Ermakova E. V., Murugova T. N., Badreeva D. R., Dushanov E., Kondela T., Kholmurodov Kh., Kuklin A., Kučerka N. (2020). Interactions in the model membranes mimicking preclinical conformational diseases. In Advances in Biomembranes and Lipid Self-Assembly (Vol. 31, pp. 185-214). Academic Press.